Notícia
Proteína altamente instável pode levar à neurodegeneração
Pesquisadores reproduziram principais características dos agregados de proteínas patológicas encontrados no cérebro de pacientes com esclerose lateral amiotrófica e outras doenças neurológicas
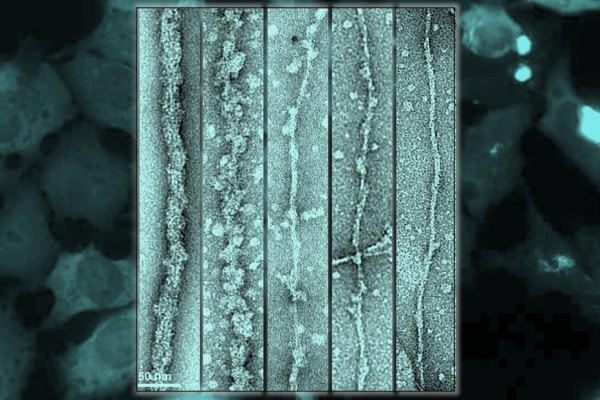
Galina Limorenko, EPFL
Fonte
EPFL | Escola Politécnica Federal de Lausanne
Data
domingo, 11 junho 2023 12:05
Áreas
Biologia. Biotecnologia. Engenharia Biológica. Microbiologia. Neurociências. Neurologia. Proteômica. Saúde Pública.
Várias doenças neurodegenerativas, como Alzheimer, Parkinson e doença de Lou Gehrig, também conhecida como esclerose lateral amiotrófica (ELA), são causadas por proteínas que se perdem e começam a se agregar em fibrilas que se acumulam em regiões específicas do cérebro.
Recentemente, cientistas da Escola Politécnica Federal de Lausanne (EPFL), na Suíça, descobriram um novo mecanismo que explica como os agregados se tornam patológicos e se espalham para diferentes regiões do cérebro. Um dos principais suspeitos é a proteína altamente instável chamada TDP43. Os cientistas descobriram que os agregados TDP43 que se formam no cérebro não são implicitamente patogênicos até que sejam processados para revelar seu núcleo ‘pegajoso’. Os resultados foram publicados na revista científica Nature Neuroscience.
A agregação da proteína TDP43 é uma característica da ELA e de outras doenças neurodegenerativas. Uma vez formados, os agregados de TDP43 podem se espalhar para diferentes regiões do cérebro, onde corrompem a TDP-43 normal e funcional. Mas o que desencadeia a agregação da TDP-43 em primeiro lugar? Quais são os mecanismos responsáveis por desencadear seus efeitos patogênicos? Essa lacuna de conhecimento dificulta o desenvolvimento de drogas eficazes para bloquear a agregação de TDP-43 ou neutralizar suas propriedades tóxicas.
Liberando os efeitos patogênicos da TDP43 por clivagem
Neste último estudo EPFL conduzido em colaboração com cientistas da Universidade da Pensilvânia, nos Estados Unidos, o Dr. Senthil Kumar e o professor Dr. Hilal Lashuel descobriram um novo mecanismo responsável por desencadear os efeitos patogênicos do agregado TDP43, preparado em tubo de ensaio ou isolado de cérebros de pacientes post mortem. As superfícies desses agregados TDP43 devem primeiro ser clivadas por enzimas para revelar superfícies ‘pegajosas’ ocultas que atraem proteínas TDP-43 normais e induzem a formação de mais agregados.
“A descoberta foi facilitada pela nossa capacidade de desenvolver um novo método para a produção de fibrilas, em laboratório, que compartilham características morfológicas e estruturais com as encontradas no cérebro de pacientes com ELA”, disse o Dr. Senthil Kumar, primeiro autor do artigo.
Usando microscopia crioeletrônica, onde as amostras são congeladas criogenicamente antes de serem vistas através de um microscópio eletrônico, os pesquisadores mostraram que os filamentos de TDP-43 estão ‘enterrados’ dentro de um filamento maior e são inacessíveis, ou seja, ainda não patológicos, porque estão cobertos pelas partes globulares da proteína. Enquanto esses filamentos estiverem ‘enterrados’, eles existem em modo furtivo e não são acessíveis a outras moléculas ou proteínas. Em outras palavras, a TDP43 torna-se patológica quando seu revestimento externo é clivado para revelar seus filamentos internos ‘pegajosos’, mas permanece em modo furtivo quando seu revestimento externo está intacto.
“Nossas descobertas sugerem que inibir as enzimas responsáveis pela clivagem do filamento de TDP-43 representa uma estratégia terapêutica viável para retardar a formação de agregados TDP-43 e impedir sua propagação no cérebro, retardando assim a progressão da doença. Como próximo passo, planejamos identificar essas enzimas e determinar se a inibição de sua atividade pode impedir a agregação de TDP-43 e a neurodegeneração em modelos celulares e animais de ELA”, disse o Dr. Hilal Lashuel, professor da EPFL que dirige o laboratório que liderou o estudo.
Os novos resultados também têm implicações para o desenvolvimento de novas ferramentas e métodos para o diagnóstico precoce de ELA e outras doenças neurodegenerativas. A camada globular protetora pode explicar por que as fibrilas TDP-43 são tão difíceis de detectar. Métodos e corantes padrão comumente usados para detectar e monitorar a formação de fibrilas por outras proteínas suspeitas no cérebro muitas vezes falharam em detectar fibrilas TDP-43. “[Isso] também explica por que tem sido muito desafiador desenvolver agentes de imagem usando fibrilas TDP-43 intactas. Esses agentes de imagem são extremamente necessários para permitir o diagnóstico precoce, monitorar a progressão da doença e avaliar a eficácia de novas terapias”, concluiu o Dr. Kumar.
Acesse o artigo científico completo (em inglês).
Acesse a notícia completa na página da Escola Politécnica Federal de Lausanne (em inglês).
Fonte: Hillary Sanctuary, EPFL. Imagem: Ilustração indica como a exposição do núcleo de fibrila TDP-43 aumenta a formação patológica na célula. Fonte: Galina Limorenko, EPFL.
Em suas publicações, o Canal Farma da Rede T4H tem o único objetivo de divulgação científica, tecnológica ou de informações comerciais para disseminar conhecimento. Nenhuma publicação do Canal Farma tem o objetivo de aconselhamento, diagnóstico, tratamento médico ou de substituição de qualquer profissional da área da saúde. Consulte sempre um profissional de saúde qualificado para a devida orientação, medicação ou tratamento, que seja compatível com suas necessidades específicas.
Os comentários constituem um espaço importante para a livre manifestação dos usuários, desde que cadastrados no Canal Farma e que respeitem os Termos e Condições de Uso. Portanto, cada comentário é de responsabilidade exclusiva do usuário que o assina, não representando a opinião do Canal Farma, que pode retirar, sem prévio aviso, comentários postados que não estejam de acordo com estas regras.





Por favor, faça Login para comentar