Notícia
Cientistas descobrem uma nova via de sinalização e projetam novo medicamento para fibrose hepática
Pesquisa pode levar ao tratamento de uma variedade de doenças e condições hepáticas
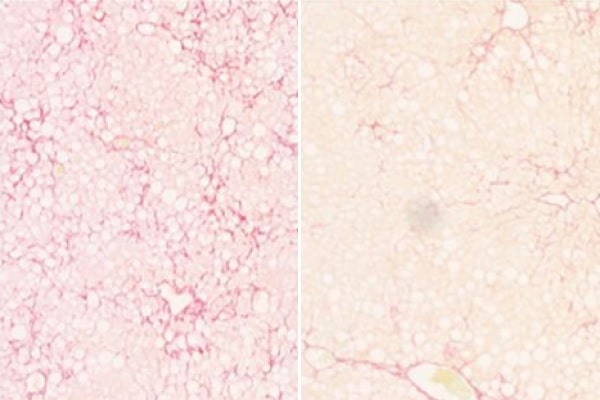
Divulgação, UCSD Health Sciences
Fonte
UCSD | Universidade da Califórnia em San Diego
Data
domingo, 28 abril 2024 13:50
Áreas
Biologia. Biomedicina. Bioquímica. Biotecnologia. Desenvolvimento de Fármacos. Engenharia Biológica. Entrega de Medicamentos. Farmacologia. Hepatologia. Indústria Farmacêutica. Microbiologia. Química Medicinal. Saúde Pública.
Um fígado saudável filtra todo o sangue do corpo, decompõe as toxinas e digere as gorduras. Produz colágeno para reparar células danificadas quando o fígado é ferido. No entanto, o fígado pode produzir muito colágeno quando um acúmulo excessivo de gordura causa inflamação crônica, uma condição chamada esteatohepatite associada à disfunção metabólica (MASH). Em um estágio avançado, a MASH pode causar cirrose, câncer de fígado e morte relacionada ao fígado.
As células que produzem colágeno no fígado são chamadas de células estreladas hepáticas (HSC). Em um novo artigo publicado na revista científica Cell Metabolism, cientistas da Universidade da Califórnia em San Diego (UCSD), nos Estados Unidos, investigaram como essas células são ativadas. Eles encontraram uma via de sinalização de três componentes no núcleo que funciona de acordo com uma espécie de modelo de polícia controlando a polícia.
Em fígados saudáveis, a primeira molécula da via inibe uma segunda molécula, que inibe a molécula que estimula os genes produtores de colágeno. A MASH reduz a primeira molécula, de modo que a inibição é eliminada na segunda e terceira moléculas, levando à estimulação da produção de colágeno.
Depois de descobrir a via de sinalização, os cientistas projetaram um pequeno trecho de RNA para provar que a via se comportava da maneira que eles pensavam. Este RNA, denominado oligonucleotídeo antisense (ASO), foi tão eficaz que não apenas provou a viabilidade da via, mas também evitou a fibrose hepática – excesso de colágeno no fígado – sem causar quaisquer efeitos colaterais. Os cientistas estão atualmente discutindo o licenciamento do ASO como medicamento com várias empresas farmacêuticas e de biotecnologia.
“Todas as moléculas da via eram conhecidas, mas ninguém sabia se ou como interagiam. Descobrimos o caminho, mostrando cada etapa deste módulo de sinalização intracelular. Essa foi a ciência da pesquisa. A mensagem clínica é este ASO, que pode realmente bloquear a fibrose hepática”, disse o Dr. Jerrold Olefsky, professor de Medicina, vice-reitor de pesquisa integrativa na UCSD Health Sciences e autor sênior do artigo.
Os cientistas realizaram suas investigações em organoides – minúsculos fígados produzidos a partir de três tipos de células hepáticas alimentados com um coquetel MASH de ácidos graxos, frutose e açúcares. Eles descobriram que, em fígados normais, o primeiro componente da via, uma proteína nuclear de sete transmembranas chamada TM7SF3, inibe um fator de splicing chamado hnRNPU. O hnRNPU evita separar um éxon inibitório no RNA mensageiro (mRNA) de TEAD1, um fator de transcrição que controla os genes que produzem o colágeno. O éxon inibitório, éxon 5, impede que o TEAD1 ative os genes produtores de colágeno.
Nos organoides alimentados com MASH, o TM7SF3 é reduzido e não inibe o fator de splicing: o fator de splicing ativo une o éxon inibitório no fator de transcrição, que ativa os genes que produzem colágeno. Isso é chamado de splicing alternativo.
Prosseguindo em suas investigações, os pesquisadores projetaram um ASO para impedir que o hnRNPU separasse o éxon 5. “Ele tinha a sequência que o colocaria logo acima do éxon 5, onde o hnRPU se liga. O ASO impediu que o fator de splicing se ligasse ao mRNA do TEAD, de modo que, em última análise, não conseguiu separá-lo. Obtivemos praticamente apenas TEAD inativo quando tratamos camundongos [com] MASH com o ASO”, disse o professor Olefsky. Com o TEAD inativado, o colágeno não foi produzido. Nem a fibrose.
“Essas descobertas mostram o papel fundamental do splicing alternativo na formação da progressão da doença fibrótica do fígado”, disse o Dr. Roi Isaac, cientista assistente do projeto e primeiro autor do artigo.
Quando os ASOs são administrados por via intravenosa, eles entram em todas as células do corpo, não apenas nas células-alvo. Por acaso, os cientistas descobriram que, dentro do fígado, esse mecanismo hnRNPU operava apenas em células estreladas. Isso tornou seu ASO altamente eficaz e altamente específico – características importantes de um bom design de medicamentos.
O Dr. Roi Isaac e o Dr. Jerrold Olefsky são coinventores e já requisitaram patente sobre o uso do ASO 56 como inibidor da fibrose hepática.
Acesse o resumo do artigo científico (em inglês).
Acesse a notícia completa na página da Universidade da Califórnia em San Diego (em inglês).
Fonte: Judith Myers, UCSD. Imagem: Fibrose medida por coloração Sirius red em camundongos MASH não tratados, à esquerda, e em camundongos tratados com ASO 56. Fonte: Divulgação, UCSD Health Sciences.
Em suas publicações, o Canal Farma da Rede T4H tem o único objetivo de divulgação científica, tecnológica ou de informações comerciais para disseminar conhecimento. Nenhuma publicação do Canal Farma tem o objetivo de aconselhamento, diagnóstico, tratamento médico ou de substituição de qualquer profissional da área da saúde. Consulte sempre um profissional de saúde qualificado para a devida orientação, medicação ou tratamento, que seja compatível com suas necessidades específicas.
Os comentários constituem um espaço importante para a livre manifestação dos usuários, desde que cadastrados no Canal Farma e que respeitem os Termos e Condições de Uso. Portanto, cada comentário é de responsabilidade exclusiva do usuário que o assina, não representando a opinião do Canal Farma, que pode retirar, sem prévio aviso, comentários postados que não estejam de acordo com estas regras.





Por favor, faça Login para comentar