Notícia
Pesquisadores descobrem que metabolismo dos tumores é mais lento do que se imaginava
Cientistas nunca souberam exatamente quanta energia um tumor cancerígeno gasta durante o crescimento no corpo de um mamífero
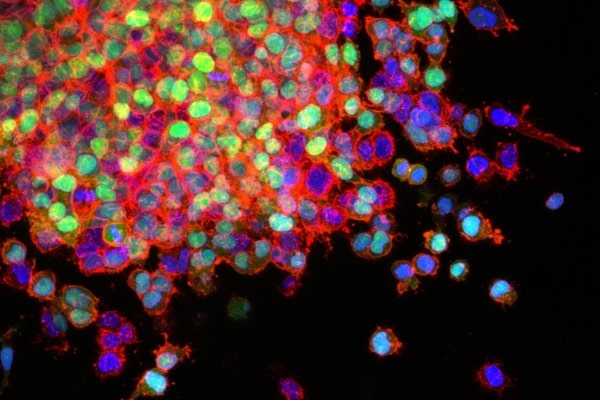
Winship Cancer Institute da Universidade Emory via NCI/NIH Visuals Online
Fonte
Universidade Princeton
Data
domingo, 12 fevereiro 2023 12:25
Áreas
Bioinformática. Biologia. Biomedicina. Bioquímica. Biotecnologia. Metabolismo. Microbiologia. Oncologia. Saúde Pública.
Os cientistas nunca souberam exatamente quanta energia um tumor cancerígeno gasta durante o crescimento no corpo de um mamífero. Mas havia a hipótese de que seria consumida uma grande quantidade de energia, colocando os tecidos saudáveis – o coração, o fígado, o pâncreas – em desvantagem.
Mas, em um novo estudo, pesquisadores do Departamento de Química da Universidade Princeton e do Ludwig Princeton Branch – o Centro de Estudos em Câncer de Princeton – demonstram pela primeira vez que o oposto é o que acontece: a conversão de nutrientes de um tumor em energia celular utilizável é acentuadamente lenta e quantificável.
Essa letargia pode ajudar os tumores a conservar energia para tarefas mais críticas, como crescimento e metástase, de acordo com a nova pesquisa publicada na revista científica Nature pelo Dr. Joshua Rabinowitz – diretor do Ludwig Princeton Branch e pesquisador do Lewis-Sigler Institute for Integrative Genomics de Princeton – e sua equipe.
Em cinco tipos diferentes de câncer, a equipe de pesquisa descobriu que os tumores foram bem-sucedidos em proliferar com baixa energia, em parte porque negligenciam as funções normais dos tecidos que os órgãos saudáveis realizam para o benefício do corpo como um todo.
A descoberta tem vastas implicações para as estratégias anti-câncer porque direciona a atenção para o metabolismo energético lento.
Alguns tratamentos propostos para pacientes com câncer giram em torno de uma estratégia de ‘deixar o tumor com o mínimo de nutrientes’, sob a suposição de que sem nutrientes um tumor não pode crescer. Do ponto de vista geral dos substratos energéticos, essa estratégia agora é, na melhor das hipóteses, questionável.
Mas os pesquisadores descobriram que os tumores usam um nutriente específico, a glicose, mais do que os tecidos normais e, portanto, se alinham com a possibilidade de combinar terapias padrão contra o câncer com dietas que reduzem a glicose circulante, como a dieta cetogênica.
“Acho que as pessoas assumem que o câncer precisa de muita energia porque tem que pagar para se dividir e proliferar. Mas ninguém realmente mediu quanta energia o câncer produz e usa em comparação com os órgãos saudáveis ”, disse a Dra. Caroline Bartman, pesquisadora associada do grupo do Dr. Rabinowitz e principal autora do artigo.
“Desenvolvemos uma maneira de medir essa energia em cânceres e encontramos uma diferença dramática entre tumores e outros tecidos. Então, agora, temos esse paradigma de que o câncer é econômico – ele vai parar de usar energia para todas essas tarefas saudáveis e apenas dedicá-la à proliferação. O que [esse resultado] diz é que esses tipos de estratégias, como ‘matar o câncer de fome’, por si só não serão boas estratégias de tratamento”.
O Dr. Joshua Rabinowitz disse que ele e sua equipe ficaram muito surpresos com os resultados de suas pesquisas: “Os tumores enfrentam um ambiente metabólico difícil porque não têm a vascularização adequada que se desenvolve no resto do corpo. E assim eles são forçados a se contentar com menos. Mas certamente, como os tumores são hipermetabólicos em tantas dimensões, esperávamos ver um metabolismo de alta energia e que isso apoiaria sua capacidade de crescer e se diferenciar”.
O rastreamento de isótopos quantifica o uso de energia
Para quantificar a energia, a equipe usou um método de investigação chamado rastreamento de isótopos, que envolve rotular nutrientes com isótopos pesados e monitorar a rapidez com que são metabolizados em mamíferos.
Tecidos e órgãos em mamíferos obtêm energia para o trabalho que realizam principalmente por meio do ciclo do ácido tricarboxílico (TCA), que oxida gordura e carboidratos para produzir a moeda primária de energia, o ATP. Cerca de 95% do ATP (energia utilizável em mamíferos) passa por esse ciclo. Ao estudar a velocidade da absorção de nutrientes da corrente sanguínea para o ciclo do TCA, os pesquisadores foram capazes de quantificar quanta energia os tecidos cancerosos estão gerando e usando em comparação com o tecido saudável.
Nos cânceres de pulmão, pâncreas e cólon, por exemplo, os pesquisadores encontraram um fluxo lento de TCA e um ciclo de produção de ATP em tumores sólidos ‘primários’, ou seja, tumores que ainda não haviam começado a se espalhar. Eles também descobriram que o câncer metastático produzia e usava mais energia do que os tumores primários e o fazia em um nível comparável aos tecidos saudáveis.
As descobertas levaram os pesquisadores a concluir que as células cancerígenas eliminam funções específicas [dos tecidos] energeticamente caras para reservar energia para o crescimento do tumor. Esta é a primeira vez que a produção de energia do tumor foi quantificada in vivo e como parte de um estudo comparativo.
Alguns dos métodos que os pesquisadores estão usando agora já foram explorados antes, disse a Dra. Caroline Bartman. A via do ciclo do TCA, por exemplo, foi descoberta há cerca de 80 anos. Mas os avanços tecnológicos e a melhor espectrometria estão fornecendo novas descobertas surpreendentes.
“Acho que é um momento emocionante para este campo porque, com os avanços dos últimos 50 anos, é um momento realmente frutífero para voltar e revisitar todos esses conceitos antigos e usá-los para entender melhor as doenças e o câncer agora”, concluiu a Dra. Caroline Bartman.
Acesse o resumo do artigo científico (em inglês).
Acesse a notícia completa na página da Universidade Princeton (em inglês).
Fonte: Wendy Plump, Departamento de Química da Universidade Princeton. Imagem: células de câncer de pulmão invadindo os tecidos circundantes e começando a se espalhar (metástase). Essas células de câncer de pulmão têm uma mutação de um gene chamado LKB1 (em verde) que promove a invasão. A actina, uma proteína do citoesqueleto, está em vermelho e o núcleo da célula está em azul. Fonte: Winship Cancer Institute da Universidade Emory via NCI/NIH Visuals Online.
Em suas publicações, o Canal Farma da Rede T4H tem o único objetivo de divulgação científica, tecnológica ou de informações comerciais para disseminar conhecimento. Nenhuma publicação do Canal Farma tem o objetivo de aconselhamento, diagnóstico, tratamento médico ou de substituição de qualquer profissional da área da saúde. Consulte sempre um profissional de saúde qualificado para a devida orientação, medicação ou tratamento, que seja compatível com suas necessidades específicas.
Os comentários constituem um espaço importante para a livre manifestação dos usuários, desde que cadastrados no Canal Farma e que respeitem os Termos e Condições de Uso. Portanto, cada comentário é de responsabilidade exclusiva do usuário que o assina, não representando a opinião do Canal Farma, que pode retirar, sem prévio aviso, comentários postados que não estejam de acordo com estas regras.





Por favor, faça Login para comentar