Notícia
Começam testes clínicos com remdesivir associado ao interferon beta-1a para tratamento da COVID-19
Estudo clínico randomizado e controlado deverá inscrever mais de 1.000 adultos hospitalizados com a COVID-19 em até 100 locais nos Estados Unidos e no exterior
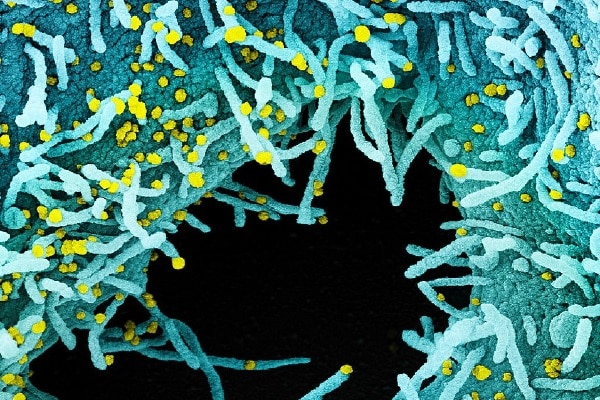
NIAID, NIH
Fonte
NIH | Institutos Nacionais de Saúde
Data
sexta-feira, 14 agosto 2020 07:10
Áreas
Doenças Infecciosas. Estudo Clínico. Farmacologia. Saúde Pública.
Um ensaio clínico randomizado e controlado avaliando a segurança e eficácia de um regime de tratamento que consiste no antiviral remdesivir mais o imunomodulador interferon beta-1a em pacientes com a COVID-19 foi iniciado há poucos dias. O estudo, denominado Adaptive COVID-19 Treatment Trial 3 (ACTT 3), deverá inscrever mais de 1.000 adultos hospitalizados com a COVID-19 em até 100 locais nos Estados Unidos e no exterior. O Instituto Nacional de Alergia e Doenças Infecciosas (NIAID), um dos institutos do NIH (Institutos Nacionais de Saúde dos Estados Unidos), está patrocinando o estudo.
O estudo ACTT 3 é a terceira iteração no NIAID. O ACTT começou em 21 de fevereiro de 2020 para avaliar o remdesivir, um antiviral de amplo espectro descoberto e desenvolvido pela empresa Gilead Sciences, da Califórnia. Uma análise preliminar dos dados do ACTT revelou que os pacientes que receberam remdesivir tiveram um tempo – estatisticamente significativo – mais curto para a recuperação em comparação com os pacientes que receberam placebo. Esses resultados foram publicados no dia 22 de maio.
O interferon beta-1a subcutâneo, um medicamento fabricado pela Merck KGaA (em Darmstadt, na Alemanha), está aprovado nos EUA e em mais de 90 outros países para o tratamento da esclerose múltipla. O medicamento é comercializado sob a marca Rebif pela EMD Serono, empresa biofarmacêutica norte-americana da Merck KGaA. O interferon beta-1a tem a mesma sequência de aminoácidos de uma proteína natural chamada interferon beta, que faz parte de uma classe de proteínas denominada interferons tipo 1. As células infectadas normalmente produzem interferons tipo 1 para ajudar o sistema imunológico a lutar contra patógenos, especialmente vírus. O interferon beta possui propriedades antivirais e antiinflamatórias.
Estudos laboratoriais sugerem que a resposta normal do interferon é suprimida em algumas pessoas após a infecção pelo SARS-CoV-2, o vírus que causa o COVID-19. No laboratório, o interferon tipo 1 pode inibir o SARS-CoV-2 e dois vírus intimamente relacionados, o SARS-CoV e o MERS-CoV. Além disso, dois pequenos ensaios clínicos randomizados sugerem que o tratamento com interferon beta pode beneficiar os pacientes com COVID-19. A combinação de interferon beta-1a e remdesivir para o tratamento de COVID-19 não tinha sido avaliada em um grande ensaio clínico randomizado até aqui.
De acordo com os protocolos de pesquisa clínica padrão, os pacientes elegíveis que fornecerem consentimento informado participarão do ACTT 3. Os participantes devem ter infecção por SARS-CoV-2 confirmada em laboratório com evidência de envolvimento pulmonar, incluindo necessidade de oxigênio suplementar, radiografias torácicas anormais, ou doença que requer ventilação mecânica. Pessoas com infecção confirmada que apresentam sintomas leves ou nenhum sintoma aparente não serão incluídas no estudo.
Os participantes do ACTT 3 estão sendo aleatoriamente designados em uma proporção de 1 para 1 para receber interferon beta-1a subcutâneo mais remdesivir (terapia combinada) ou remdesivir sozinho. Nem os participantes nem a equipe do estudo saberão quem está recebendo qual regime de tratamento. Todos os participantes receberão doses padrão de remdesivir e interferon beta-1a ou placebo. Aqueles no grupo de terapia combinada receberão interferon beta-1a como uma injeção subcutânea de 44 microgramas em dias alternados para um total de quatro doses durante a hospitalização. Aqueles no grupo apenas com remdesivir receberão uma injeção subcutânea de placebo correspondente em dias alternados para um total de quatro doses durante a hospitalização.
Os investigadores avaliarão se o tempo de recuperação é menor no grupo de terapia combinada em relação ao grupo apenas com remdesivir. A recuperação é definida como o participante estar bem o suficiente para alta hospitalar, o que significa que o participante não necessita mais de oxigênio suplementar ou cuidados médicos contínuos no hospital, ou não está mais hospitalizado (com ou sem alguma limitação de atividades). A recuperação é avaliada até o dia 29. Um objetivo secundário chave do estudo é comparar os resultados dos pacientes no dia 15 usando uma escala ordinal de oito pontos que varia de totalmente recuperado até o óbito. O ensaio também irá comparar outras variáveis de resultado secundário entre grupos de tratamento, incluindo a mortalidade isolada.
Uma placa independente de monitoramento de dados e segurança (DSMB) monitorará os resultados contínuos para garantir o bem-estar e a segurança do paciente, bem como a integridade do estudo. Os resultados preliminares são esperados para os próximos meses.
Acesse a notícia completa na página do NIH.
Fonte: NIAID/NIH. Imagem: Micrografia eletrônica de varredura colorida de uma célula fortemente infectada com partículas do vírus SARS-CoV-2 (em amarelo), isolada de uma amostra de paciente. A área preta na imagem é o espaço extracelular entre as células. Imagem capturada no NIAID Integrated Research Facility (IRF) em Fort Detrick, Maryland. Fonte: NIAID/NIH.
Em suas publicações, o Canal Farma da Rede T4H tem o único objetivo de divulgação científica, tecnológica ou de informações comerciais para disseminar conhecimento. Nenhuma publicação do Canal Farma tem o objetivo de aconselhamento, diagnóstico, tratamento médico ou de substituição de qualquer profissional da área da saúde. Consulte sempre um profissional de saúde qualificado para a devida orientação, medicação ou tratamento, que seja compatível com suas necessidades específicas.
Notícias relacionadas
Os comentários constituem um espaço importante para a livre manifestação dos usuários, desde que cadastrados no Canal Farma e que respeitem os Termos e Condições de Uso. Portanto, cada comentário é de responsabilidade exclusiva do usuário que o assina, não representando a opinião do Canal Farma, que pode retirar, sem prévio aviso, comentários postados que não estejam de acordo com estas regras.





Por favor, faça Login para comentar